Questions Réponses

1. Qu’est qu’un anévrysme de l’aorte ?

C’est une dilatation de l’aorte, localisée ou étendue, égale ou supérieure à 1,5 fois le diamètre théorique.
Ce diamètre théorique varie en fonction de l’âge, du genre, du morphotype.
Il est grossièrement de 30 à 35 mm au niveau de l’aorte ascendante, de 25 à 30 mm au niveau de l’aorte descendante, de 20 à 25 mm au niveau de l’aorte abdominale.
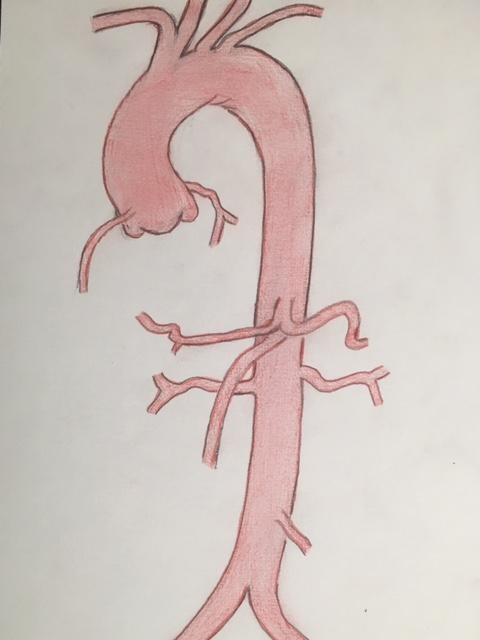
On parle donc d’un anévrysme de l’aorte ascendante lorsque le diamètre aortique dépasse 45 mm, d’anévrysme de l’aorte descendante à partir de 40 mm, d’anévrysme de l’aorte abdominale à partir de 35 mm.
2. Quel est le risque évolutif d’un anévrysme de l’aorte ? Est-ce que les anévrysmes font courir le même risque quelque soit leur localisation ?

Le risque évolutif d’un anévrysme de l’aorte est à terme, inéluctablement, la rupture. Cette complication gravissime est souvent létale, alors que le traitement des anévrysmes non compliqués de l’aorte est bien codifié et donne d’excellents résultats. Il est donc primordial de favoriser le dépistage des anévrysmes avant le stade de la complication, et donc connaitre le terrain à risque :
-
Genre masculin
-
Age avancé (7ème – 8ème décennie)
-
Facteurs de risques de l’athérosclérose (tabac, hypertension, hypercholestérolémie)
-
Antécédents familiaux (relatifs du 1er degré) d’anévrysme de l’aorte.
Chez ce type de patients, une simple échographie suffit le plus souvent au dépistage de la maladie.
Toutes les localisations aortiques des anévrysmes sont susceptibles de donner lieu à la rupture. Au niveau de l’aorte ascendante, il est classique de noter que les anévrysmes sont susceptibles de favoriser la survenue d’une dissection de l’aorte, pathologie également extrêmement grave.
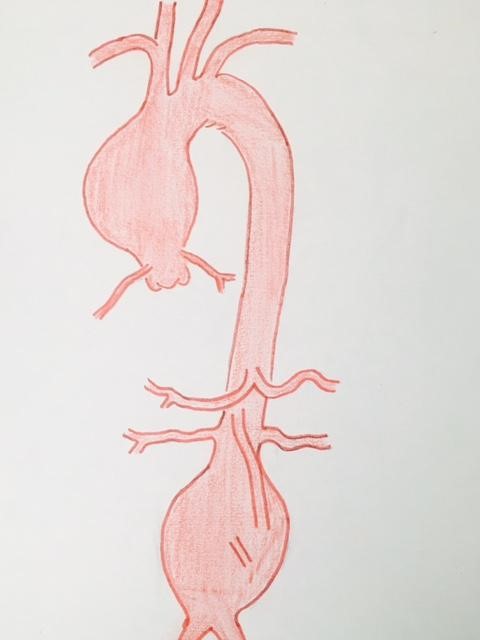
3. Le risque évolutif des anévrysmes de l’aorte abdominale est représenté par la rupture. Quels sont les critères permettant de retenir le caractère menaçant d’un anévrysme de l’aorte abdominale ?

Le caractère menaçant le plus évident est l’existence de symptômes et spécialement de douleurs. Toute douleur abdominale chez un patient porteur d’un anévrysme est, jusqu’à preuve du contraire, une menace de rupture et impose une prise en charge urgente en milieu spécialisé.
En dehors des symptômes, les critères de menace d’un anévrysme de l’aorte abdominale sont :
-
Son diamètre : plus l’anévrysme est gros, plus la menace de rupture est imminente. Le diamètre théorique de l’aorte abdominale étant de 20 à 25 mm chez l’homme, un peu moins chez la femme. La taille à partir de laquelle l’anévrysme est jugé menaçant est de 55 mm chez l’homme et de 50 mm chez la femme.
-
Sa vitesse d’expansion : elle est habituellement de 2 à 3 mm par an. Une croissance annuelle plus importante conduit logiquement à atteindre plus rapidement la valeur seuil à partir de laquelle la lésion est menaçante. On considère qu’une croissance de plus de 10 mm en un an est un élément d’évolution péjorative.
-
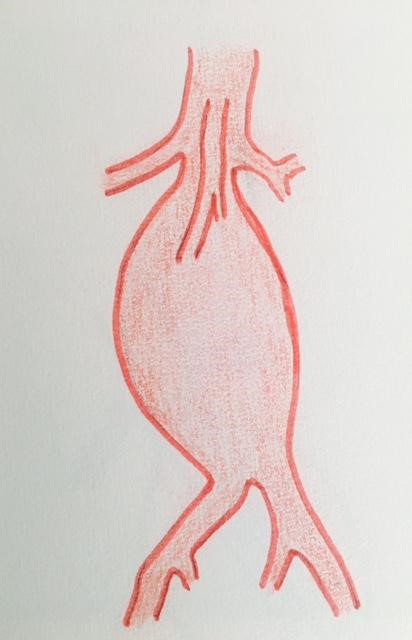
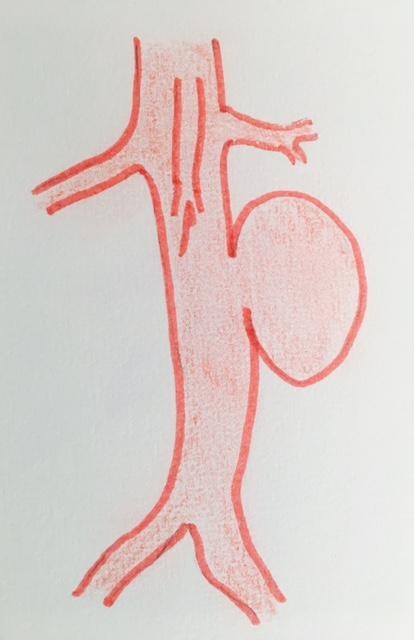
Sa forme :
L’anévrysme de l’aorte abdominale est dans la majorité des cas fusiforme. Les formes sacciformes sont considérées comme plus à risque, ce qui autoriserait le traitement des anévrysmes de petit diamètre. Cependant, cette recommandation n’a jamais été formellement validée.
4. En quoi consiste le traitement des anévrysmes de l’aorte abdominale ? Quelles sont les techniques à notre disposition ?

Son caractère familial : les malades qui ont une histoire familiale marquée d’anévrysme de l’aorte abdominale pourraient avoir un risque plus élevé de rupture, en particulier s’ils sont de genre féminin.
Le traitement consiste à prévenir la rupture. Donc lorsque l’on considère qu’il existe un risque de rupture à court terme, ou en cas de complication, le but du traitement est de stopper l’évolution de l’anévrysme.
Le traitement le plus radical, le plus ancien, est la mise à plat greffe chirurgicale. Ce traitement consiste, par une voie d’abord chirurgicale, à interrompre brièvement la circulation au niveau de l’anévrysme (il ne s’agit pas d’utiliser une circulation extra corporelle), à supprimer l’anévrysme et à rétablir la circulation par l’intermédiaire d’une prothèse artérielle habituellement en polyester.
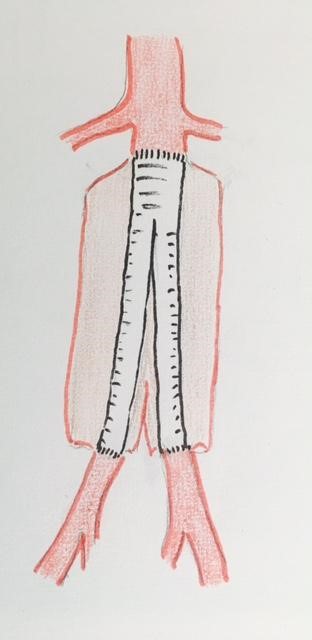
La voie d’abord chirurgicale peut être conventionnelle (trans ou rétro péritonéale) ou mini invasive (assistée par cœlioscopie ou robot).
L’avantage de ce traitement est qu’il est curatif, définitif. Ses inconvénients sont la nécessité d’accéder à l’aorte, d’interrompre momentanément la circulation au niveau de l’anévrysme, il s’agit donc d’une opération relativement lourde.
L’alternative au traitement chirurgical curatif est la mise en place par voie transfémorale (plis de l’aine), sous contrôle radiologique, d’une endoprothèse destinée à exclure l’anévrysme de la circulation.
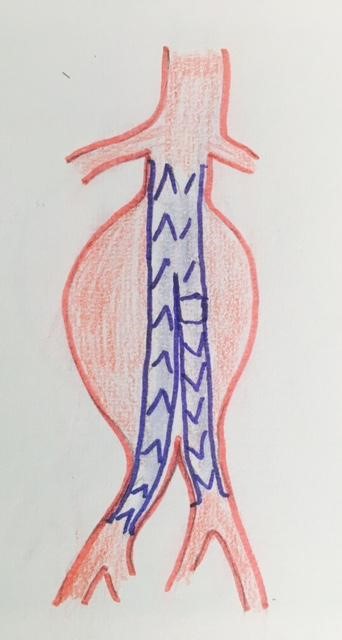
Les avantages de cette technique sont qu’elle ne nécessite ni ouverture de l’abdomen, ni interruption momentanée de la circulation aortique.
En dehors d’un coût plus élevé, son inconvénient principal est qu’elle laisse l’anévrysme en place, et qu’il faut donc s’assurer par une surveillance à vie (échographie et/ou scanner) que cet anévrysme est bien exclu de la circulation, qu’il n’existe pas « d’endofuites ». Cette dernière complication s’observe dans 15 à 20 % des cas.
Le choix de l’une ou l’autre de ces deux techniques repose sur la présentation anatomique de l’anévrysme et sur l’évaluation du risque opératoire.
Il parait logique de proposer la technique chirurgicale conventionnelle aux patients les plus jeunes, ayant une espérance de vie importante et un risque opératoire minime.
La technique par endoprothèse doit être raisonnablement proposée aux patients ayant une espérance de vie moins importante, un risque opératoire élevé, et une présentation anatomique de l’anévrysme favorable.
Dans tous les cas, le centre proposant la prise en charge doit être à même de maitriser au mieux toutes les techniques disponibles, et l’information du malade doit être la plus claire possible, afin que son avis puisse être pris en compte.
Lors d’une intervention élective, et quelque soit la technique retenue, la risque de décès postopératoire doit demeurer au-dessous de 3 %, le risque de complication inférieur à 10%.
5. Dans quels cas doit-on écarter le traitement endovasculaire par endoprothèse des anévrysmes de l’aorte abdominale ?

L’une des différences notables entre le traitement chirurgical conventionnel et le traitement par endoprothèse réside dans les points d’ancrage du dispositif implanté.
Ces points d’ancrage se situent classiquement au niveau de l’aorte immédiatement sous-rénale et des deux artères iliaques communes.
Si l’opération est faite de manière conventionnelle, les points d’ancrages sont des sutures entre l’artère et la prothèse, et ces sutures peuvent s’adapter à une anatomie défavorable, sans risque de fuite.
Si en revanche on implante une endoprothèse, il n’y a pas de suture, mais une opposition des extrémités du dispositif sur les zones artérielles d’ancrage. Il y a donc un risque de fuite si ces zones d’opposition ne sont pas sûres, c'est-à-dire si l’anatomie de l’anévrysme n’est pas adaptée à la technique. Dans ce cas, il faut écarter la possibilité d’utiliser une endoprothèse ou bien se servir d’artifices pour s’assurer un ancrage sûr, comme par exemple une endoprothèse fenêtrée à son extrémité proximale, ce qui permet d’inclure les artères rénales ou digestives dans la reconstruction.
6. Dans quels domaines se concentre l’innovation pour améliorer les performances des endoprothèses de l’aorte abdominale ?

L’innovation se concentre dans trois domaines pour améliorer les performances des endoprothèses de l’aorte abdominale.
-
Améliorer la navigation à travers les artères et diminuer la taille, le diamètre du cathéter porteur, du « lanceur ». En quelques années ainsi, les cathéters sont passés d’une taille de 24 Fr (8mm), à 16 Fr ou moins (5mm). Cela permet d’effectuer les procédures de manière percutanée (sans incision chirurgicale) au niveau des artères fémorales, chez des malades ayant un réseau artériel et spécialement iliaque de petit calibre (femmes), ou surchargé.
-
Permettre de s’affranchir de conditions anatomiques défavorables, essentiellement de zones d’ancrage (« collets ») inadéquates. Ainsi, lorsque la distance entre les artères rénales et le pôle supérieur de l’anévrysme est trop courte (inférieure à 15 mm), les développements récents proposent des endoprothèses « fenêtrées », ces fenêtres préservant la perméabilité des artères rénales.

Par ailleurs, lorsque ce « collet » proximal n’est pas d’une qualité parfaite, l’ancrage de l’endoprothèse peut être sécurisé par un système d’agrafes.
-
Eviter que le « sac » anévrysmal résiduel ne continue à grossir car alimenté par des « endofuites » liées à de petites artères collatérales comme les artères lombaires ou l’artère mésentérique inférieure. Pour ce faire, on propose d’emboliser, de « boucher » ces petites artères par un matériel spécifique, ou de provoquer la thrombose du sac par du matériel placé en son sein.
Ces innovations peuvent améliorer les résultats de la technique, mais ont un coût très important, ce qui peut susciter des interrogations sur leur pertinence.
7. Qu’est ce que la dissection aortique aiguë ? Comment en évaluer la gravité ?

La dissection aortique est une déchirure de la paroi de l’aorte qui résulte dans la création, à l’extérieur de la vraie lumière artérielle, d’un second chenal, dit faux chenal, plus ou moins étendu. L’évolution de ce faux chenal est imprévisible. Il peut se développer sous forme anévrysmale jusqu’à la rupture, il peut comprimer la vraie lumière artérielle, ce qui conduit à des complications ischémiques (syndrome de « malperfusion »), il peut se thromboser pour former un hématome, il peut se stabiliser.
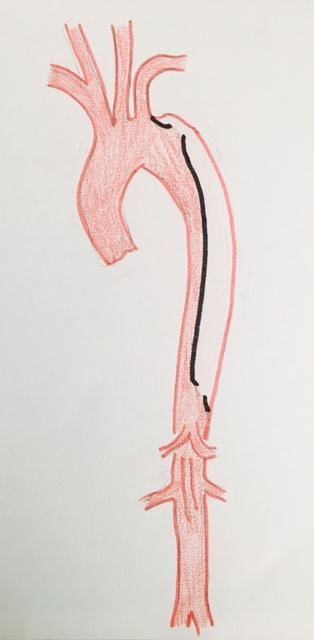
Cette affection relativement rare se caractérise par son exceptionnelle gravité, avec pour les formes les plus graves une mortalité de 50% dans les 48 premières heures en l’absence d’une prise en charge adéquate.
La gravité d’une dissection s’évalue d’abord par sa localisation, et surtout par l’atteinte de l’aorte ascendante.
La classification de Stanford décrit deux formes anatomiques de dissections :
-
Le type A qui intéresse l’aorte ascendante, et qui justifie une intervention de remplacement aortique en urgence en raison du risque de complications cardiaques et aortiques.
-
Le type B, intéresse l’aorte descendante, la dissection prenant naissance au-delà de l’artère sous-clavière gauche. Cette forme est habituellement traitée médicalement, en dehors des complications : augmentation du faux chenal, rupture, syndrome de mal perfusion.
Donc l’évaluation de la gravité d’une dissection aortique, en dehors du terrain sur lequel elle survient, repose sur sa localisation anatomique, son extension, et sur l’existence de complications lors du diagnostic initial.
8. Dans quels cas le traitement interventionnel des dissections aortiques aiguës s’impose t ’il ?

Le traitement interventionnel s’impose dans les dissections de type A intéressant l’aorte ascendante, afin d’éviter les complications létales représentées par la rupture et l’ischémie myocardique. L’intervention de référence, réalisée en chirurgie cardiaque sous assistance circulatoire, est le remplacement prothétique de l’aorte ascendante.
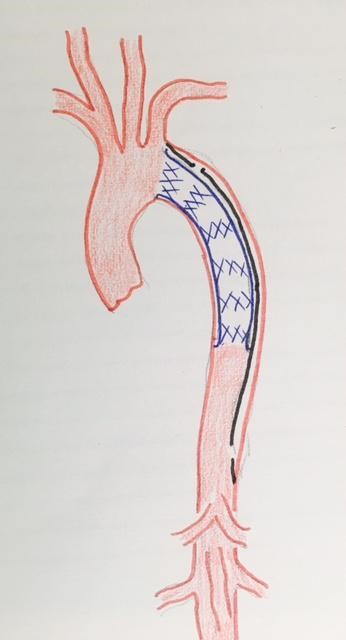
Dans les dissections de type B de Stanford, qui intéressent l’aorte descendante, le traitement initial est exclusivement médical. La survenue de complications, telles que la rupture ou la menace de la rupture, ou que le syndrome de mal perfusion (ischémie médullaire, viscérale, rénale), pose le problème du traitement interventionnel représenté par le développement des endoprothèses aortiques (« stent graft ») a révolutionné cette prise en charge, en simplifiant de manière spectaculaire le geste chirurgical. Ainsi, la survenue d’une complication conduit à l’utilisation d’une endoprothèse qui va permettre de fermer l’orifice de communication (orifice d’entrée) qui alimente le faux chenal, et de favoriser la réouverture du vrai chenal.
L’efficacité de ce traitement a conduit certaines équipes à le proposer pour le traitement des dissections non compliquées, afin de limiter les risques d’évolution péjorative. Mais le consensus n’est pas constaté et le traitement médical, spécialement le contrôle de la tension artérielle reste la référence pour la prise en charge des dissection aiguës non compliquées de type B.
9. Quelle est la part de la génétique dans les maladies de l’aorte ?

En dehors des facteurs environnementaux ou des facteurs de risque acquis tels que le tabac, des facteurs génétiques peuvent intervenir dans le développement des anévrysmes aortiques. Ce risque est beaucoup mieux établi pour les anévrysmes thoraciques que pour les anévrysmes abdominaux qui pour la majorité d’entre eux sont d’origine dégénérative.
Ainsi les maladies du tissu élastique d’origine génétique telles que la maladie de Marfan, le syndrome d’Ehlers-Danlos de type IV, le syndrome de Loeys-Dietz, le syndrome de Turner, peuvent être la cause d’anévrysmes de l’aorte thoracique jusque dans 25% des cas.
Donc en présence d’une maladie du tissu conjonctif d’origine génétique telle que celles qui sont citées, il est essentiel de dépister les complications cardiovasculaires parmi les autres modes d’expression de ces maladies, et d’orienter ces patients dans des centres spécialisés
(Centre de Compétence Marfan et apparentés, Centre Aorte, CHU Timone, 264 rue Saint Pierre, 13005 MARSEILLE).
De même, la survenue d’une maladie de l’aorte thoracique doit conduire à la recherche d’une origine génétique potentielle et éventuellement à une enquête familiale dans le cadre d’un dépistage ciblé.
Les anévrysmes de l’aorte abdominale sont dans l’immense majorité des cas d’origine dégénérative, c’est à dire liés à la maladie athéromateuse. Il est important cependant de noter qu’en dehors de tout contexte de maladie génétique, des antécédents familiaux d’anévrysmes aortiques sont retrouvés chez 10 à 15 % des patients porteurs d’anévrysmes de l’aorte abdominale.
Le risque de présenter la même maladie pour un patient de genre masculin de plus de 50 ans ayant un relatif du premier degré présentant un anévrysme de l’aorte abdominale est multiplié par 4 par rapport à la population standard.
Cela doit déboucher naturellement sur un dépistage ciblé, familial, par échographie.
De nombreuses études ont été conduites pour rechercher une contribution génétique dans ces formes familiales d’anévrysmes de l’aorte abdominale. Pour cela, on recherche une signature génétique sur le génome complet en utilisant des analyses de liaison ou d’association génétique. Des loci génétiques ont été associés à l’anévrysme de l’aorte abdominale mais on ne dispose pas à ce jour de polymorphismes génétiques utiles pour un dépistage au sein des familles à risque.
10. Quelles sont les manifestations des lésions occlusives de l’aorte abdominale et du carrefour Aortique ?

Les maladies occlusives de l’aorte terminale sont d’une grande fréquence. Elles sont liées à l’athérosclérose, atteignent préférentiellement les sujets de genre masculin de plus de 50 ans chez lesquels les facteurs de risque classiques sont retrouvés : tabac, hypercholestérolémie, hypertension artérielle. Ces obstructions de l’aorte et des artères iliaques sont caractéristiques de la maladie athéromateuse du sujet jeune (5ème, 6ème décennie), par rapport à l’atteinte sous-inguinale (artères fémorales) du sujet plus âgé.
Les manifestations de cette atteinte obstructive du carrefour aortique sont l’ischémie d’effort, qui s’exprime sous la forme de la « claudication intermittente ». Le patient, après une certaine distance de marche, ressent une douleur à type de crampe, intéressant la fesse, la cuisse, le mollet de manière uni ou bilatérale, obligeant à l’arrêt de l’effort. Le repos permet la disparition de la douleur en quelques minutes, la reprise de la marche amène sa réapparition pour la même distance (« périmètre de marche »). Ces symptômes peuvent être chez l’homme, associés à une impotence sexuelle (syndrome de Leriche).
Le diagnostic repose sur l’analyse des symptômes, du terrain (facteurs de risque), qui doit conduire à un examen clinique constatant l’abolition d’un ou plusieurs pouls artériels aux membres inférieurs. La confirmation du diagnostic se fait par un examen simple, non invasif, facilement accessible, et peu coûteux : l’écho-doppler artériel des membres inférieurs.
Le traitement repose sur la suppression des facteurs de risque et en particulier sur le sevrage du tabac, sur le changement de mode de vie avec la pratique quotidienne d’exercices de marche : STOP SMOKING, KEEP WALKING.
Ce n’est qu’en cas d’échec de ces mesures élémentaires que l’on peut être amené à proposer un traitement interventionnel, habituellement simple, percutané, guidé par les résultats d’un angioscanner qui aura alors été nécessaire.






